前言
靶向蛋白质降解(TPD)是一种新兴的治疗方法,因其在治疗上可以调节传统小分子难以靶向的蛋白质而备受关注。蛋白降解靶向嵌合体(PROTAC)是利用细胞内天然的蛋白降解体系——泛素蛋白酶系统(UPS)实现目标蛋白(POI)的靶向降解。PROTAC是异双功能的小分子,其一端靶向POI,一端招募E3泛素连接酶形成哑铃型结构的三元复合物,POI被打上泛素标签,进而被蛋白酶体识别降解。
自从首次报道了利用泛素-蛋白酶体系统降解靶蛋白的PROTAC分子概念以来的20年里,TPD已经从学术界转移到工业界,许多公司已经启动了临床前和早期临床开发的计划。2019年,第一批PROTAC分子进入临床试验;2020年,针对雌激素受体(ER)和雄激素受体(AR)癌症靶点的PROTAC临床概念得到证明。有了这一成功,目前,TPD领域现在已经准备好并致力于攻克那些被认为“不可治疗”的靶点。
PROTAC概述
PROTAC的概念最早是在2001年由Crews等人提出,能够利用机体内天然存在的蛋白清理系统,降低蛋白水平而非抑制蛋白的功能,发挥治疗疾病的目的。泛素依赖性蛋白水解是降解细胞内蛋白质的主要途径,是正常细胞维持生理过程的一部分。在该途径中,蛋白质被蛋白酶体以三步过程降解,包括泛素激活酶(E1)、泛素结合酶(E2)和泛素-蛋白质连接酶(E3),它们协调泛素分子向目标蛋白质(底物)的转移。
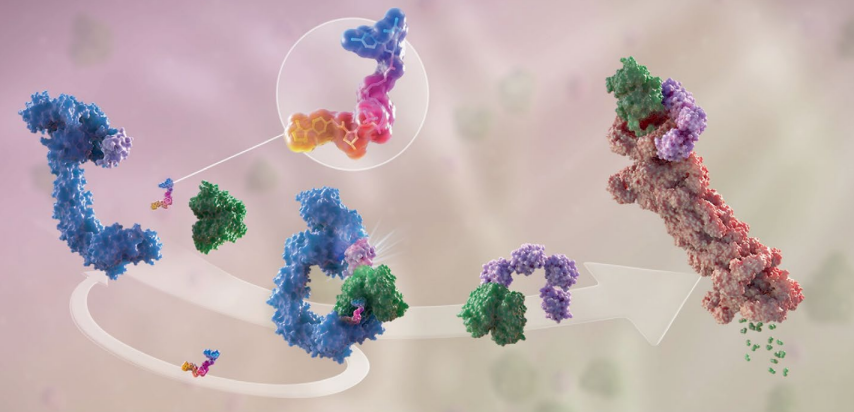
PROTAC是一种异双功能分子,可以分为三个部分:第一部分连接结合靶蛋白的配体,第二部分连接E3连接酶的配体,中间有一个连接体把第一部分和第二部分连在一起。它的作用机理非常简单,就是首先把目标蛋白和E3连接酶连在一起。这个三元复合物形成以后,泛素酶就会自动转移到目标蛋白上,然后蛋白酶体通过识别目标蛋白上的泛素酶来靶向降解目标蛋白。
PROTAC的优点
第一,PROTAC分子有催化降解功能。与每一个小分子抑制剂只能作用一个蛋白分子不同,每个PROTAC分子可以降解很多个蛋白分子,所以很低的剂量就可以有很好的药效。而且只要细胞内还存有少量的PROTAC分子,药效就可以得以保持。
第二,传统的小分子和抗体的作用模式需要抑制剂或单抗具备较高的浓度才能够占据靶点的活性位点,阻断下游信号通路的转导。而PROTAC不是影响蛋白的功能,而是介导致病靶蛋白被降解。不需要作用于蛋白的活性位点以抑制其活性,只需与靶蛋白有一定的结合率就可以,所以可以选择的靶蛋白结合体会多一些,有可能作用于一些传统意义上的不可成药的靶点。
第三,因为PROTAC通过降解目标蛋白起作用,当小分子的耐药性是因为细胞合成了更多的靶蛋白引起的情况下,PROTAC可以克服此类小分子药物耐药性的问题。总而言之, PROTAC技术结合了小分子化药,大分子生物药物以及RNAi分子的优点,有可能成为产生下一批重磅药物的关键技术。
PROTAC的发展
PROTAC的第一个时代始于Sakamoto等人于2001年发表的关键性PROTAC论文,这是第一次证明了PROTAC的体外概念验证。Protac-1被设计用于靶向甲硫酰氨基肽酶2(METAP2),这是抑制血管生成的有效靶点。Protac-1由两个结构域组成:ovalicin以及来自核因子-κB抑制剂-α(NF-κBIα)的10个氨基酸的磷酸肽,其被E3连接酶β-转导子重复序列(β-TRCP)识别。Protac-1充当METAP2和β-TRCP之间的纽带,使连接酶能够泛素化METAP2。
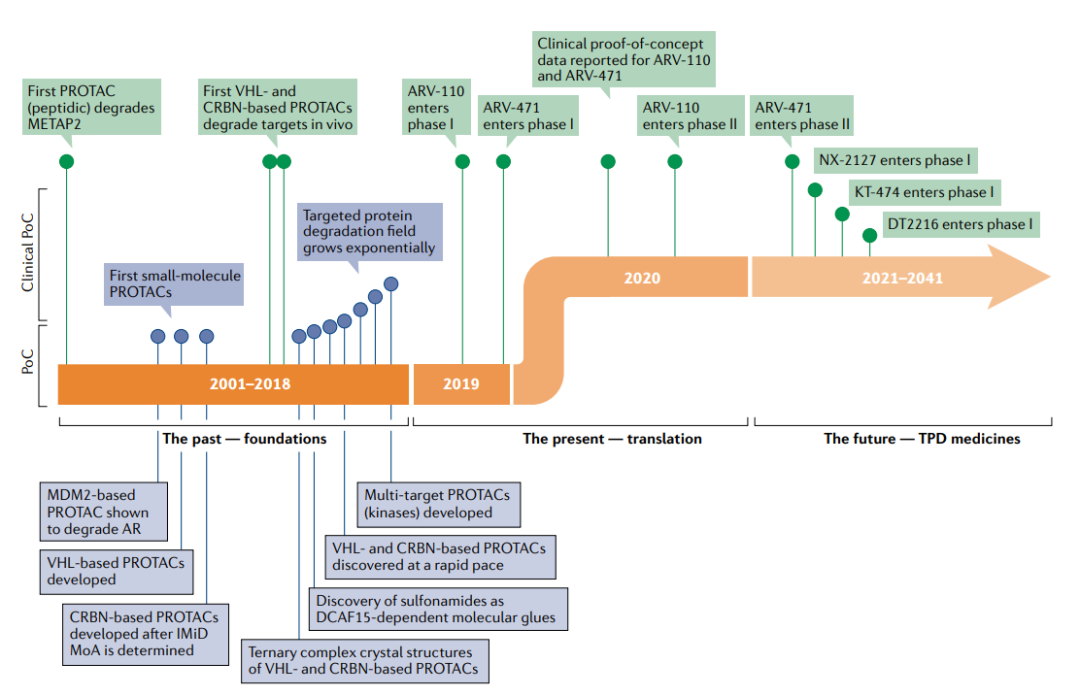
随后人们发现了一种来自缺氧诱导因子1亚单位-α(HIF1α)的肽,该肽结合vonHippel–Lindau(VHL)E3连接酶,从而设计出可降解一系列POI的细胞穿透性PROTAC。从技术上讲,这些早期的PROTAC现在被认为是“生物PROTAC”,因为它们不是完全的小分子结构,而是包含了E3连接酶的肽配体。然而,HIF1α肽的小分子模拟物的发现为完全基于小分子结构的PROTAC的设计打开了大门。从这时起,PROTAC这一领域的分子开发呈指数级增长。
2019年第一个进入临床试验的PROTAC药物ARV-110终结了TPD的这一基础时代,ARV-110通过将雄激素受体招募到CRL4–CRBN连接酶复合物中来靶向雄激素受体。从这时起,PROTAC进入了临床转化时代,在此阶段,设计用于降解致病蛋白质的多个分子进入临床,这一领域变得无比火热。
PROTAC的临床验证
在PROTAC进入临床之前,人们依然存在着多种疑问。它们会有药物一样的特性吗?它们在人类身上安全吗?它们会像预期的那样对目标蛋白起作用吗?它们会有治疗效果吗?令人鼓舞的是,2020年,ARV-110和ARV-471的第一阶段临床试验的初步阳性数据对所有四个基本问题的回答都是肯定的。
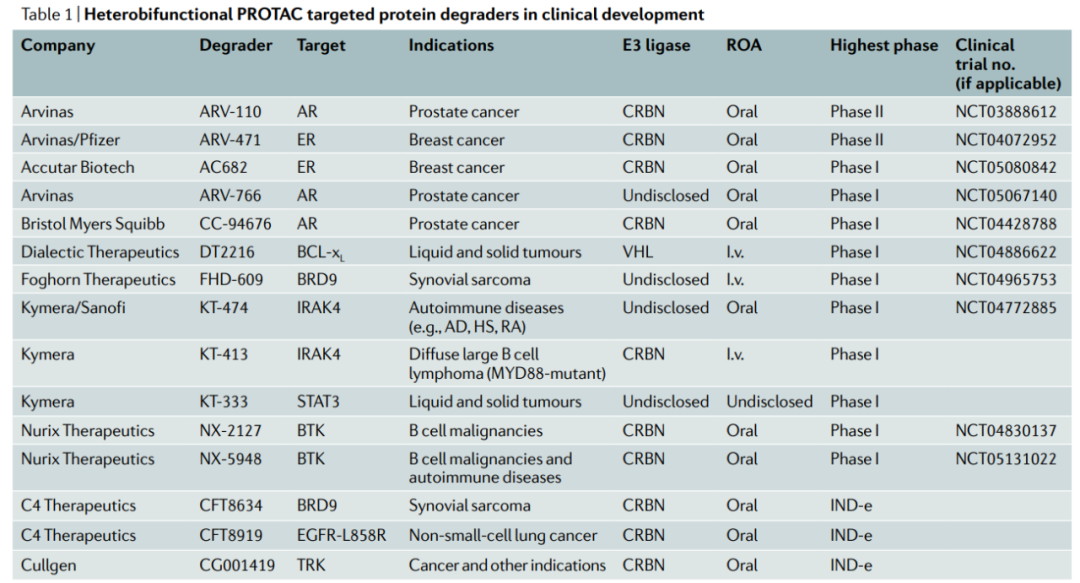
ARV-110在经多次治疗的转移性去势抵抗前列腺癌(mCRPC)患者的I期临床试验中(NCT03888612)进行了评估。这个试验是PROTAC的一个极好的测试案例,因为AR是前列腺癌和mCRPC患者的一个众所周知的驱动因素,尤其是这一难治性的亚群,由于对作为前列腺癌治疗主要手段的抗雄激素疗法不敏感或耐药,治疗选择有限。最初的试验数据表明,ARV-110在高达420mg的剂量下具有良好的耐受性。这些数据还证明了ARV-110介导的肿瘤中蛋白质靶标的降解,这是人类第一个PROTAC的分子证据,并显示出了抗肿瘤活性的迹象。这些数据支持ARV-110进行进一步的II期临床试验。
此外,另一个靶向ER的PROTAC分子ARV-471进入局部晚期或转移性乳腺癌患者的临床试验。ARV-471的中期数据显示出可控的耐受性特征,并且表现出强大的临床疗效信号,在大量预处理人群中有42%的临床受益率,并且有证据表明ER降解优于fulvestrant和其他选择性ER降解药物。目前,ARV-471作为单一药物在转移性乳腺癌中已进展到II期(NCT04072952),评估ARV-471与CDK4/CDK6抑制剂palbociclib联合使用的Ib期研究也已开始。
这两种PROTAC分子的早期数据都显示了强有力的临床表现,证明了它们理想的安全性、有效的暴露和对患者有意义的临床疗效,表明了该方法的治疗可行性。到2021年底,至少有15个靶向性PROTAC药物进入临床阶段,预计还会有更多的项目跟进。
PROTAC的开发现状
PROTAC技术的不断成熟,吸引了许多公司和资本进入这个领域。首先,PROTAC技术的先驱和领军人物纷纷创立公司,开发蛋白降解技术。国外做的比较早和比较好的公司有Arvinas、C4 Therapeutics、Kymera Therapeutics、Vividion、Nurix、Oncopia Therapeutics等。
Arvinas公司,由Crews在2013年创立,是最早布局PROTAC的公司之一,开发的蛋白降解技术主要用于肿瘤和神经系统类疾病的治疗。目前进展最快的ARV-110和ARV-471都处在II期临床试验,分别用于前列腺癌和乳腺癌的治疗。
C4 Therapeutics,成立于2015年,创始人是James Bradner。目前布局的靶点主要是跟肿瘤相关的,比如IKZF1/3、BRD9、EGFR、BRAF-V600E和RET等。该公司拥有专注于蛋白降解剂开发的平台C4T TORPEDO,用于PROTAC的设计、合成和活性评价,旨在发现高质量的蛋白降解剂。2019年1月,与百健和罗氏分别达成4.15亿美元和9亿美元的合作协议。
Kymera Therapeutics,成立于2016年,专注于用蛋白降解技术治疗癌症和免疫性炎症,布局的靶点有IRAK4、STAT3等。进展最快的是KT-474,目前在I期临床。2020年7月,其与赛诺菲达成多项计划的战略合作,获得1.5亿美元的预付款,并可能获得超过20亿美元的潜在开发、监管和销售里程碑,以及可观的特许权使用费。
Nurix,成立于2009年,专注于开发可供口服的降解剂,布局的靶点有BTK、CBL-B等。该公司利用他们在E3连接酶方面的深厚的专业知识和专有的DNA编码化合物库(DEL),建立了专有的药物发现平台DELigase,用以开发蛋白降解药物或者是抑制E3连接酶来增加有益蛋白的水平。该公司进展最快的蛋白降解药物是NX-2127,目前在临床I期,用于既往治疗失败的B细胞恶性肿瘤。
海外布局PROTAC赛道的公司除了初创的Biotech外,诺华、BMS、安进等制药巨头也纷纷加入其中。国内公司也有布局,并有可能赶超海外药企的领域。据不完全统计,国内已布局PROTAC技术的药企已超过20家,不仅有biotech,还有big pharma。海思科作为第一家国内开启临床试验的公司,位列PROTAC技术第一梯队。其他药企还有凌科药业、分迪科技、美志医药、江苏恒瑞、开拓药业、成都先导、海创药业、海和药物、领泰生物、和径医药、标新生物、诺诚健华、五元生物、美志医药、亚盛医药、科伦药业、石药集团、嘉兴优博、上海睿因、苏州德亘生物、分迪科技、多域生物、鲁南制药等。具有PROTAC开发平台的CRO公司有药明康德、康龙化成、美迪西等。
小结
在过去的20年中,PROTAC作为药物研发的一个前沿技术正在飞速发展之中,尤其在过去的几年,PROTAC已经成为一种关键的治疗方式。最近,通过I期和II期临床试验中的阳性结果,也让我们看到了PROTAC在肿瘤和其它疾病中巨大的治疗潜力。
PROTAC可布局的靶点广阔,市场巨大,相信随着该技术的不断进步和完善,PROTAC可以成为像小分子抑制剂、单抗和免疫治疗等一样成功的疗法,使更多的疾病患者从中受益。
参考文献:
1.PROTAC targeted protein degraders: the pastis prologue. Nat Rev Drug Discov. 2022 Jan 18 : 1–20.