近日,《北京市生物医药全产业链开放实施方案》(简称《方案》)正式实施。
《方案》是针对北京“两区”建设出台的第一个全产业链开放实施方案,对北京市生物医药产业从研发到临床应用等各环节实现全产业链覆盖。
值得注意的是,《方案》明确提出,将调整创新医疗项目价格管理机制、丰富商业健康保险产品供给、建立绿色通道指导医保协商、及时将更多本市创新药械纳入政府采购和推广应用范围等,推动创新技术和产品应用。此举措为创新医疗器械上市和广泛的临床应用提供强劲的支持。
医疗器械是一门涵盖多学科的高科技行业,从研发、生产到注册获批,通常需要8-10年的时间,被称为“十年磨一剑”,这当中还没有包括临床应用推广的时间。近年来出台的创新审批通道程序、注册人制度等通过改善注册、审批流程,大大缩减了创新产品注册上市时间。
据众成数科(JOINCHAIN)统计,2021年全国共108款产品进入创新医疗器械审批通道,是近8年之最,与此同时,获批数量也逐年增加,平均每年增加8件,2021年获批数量为50件,其中35件为国家级创新医疗器械。
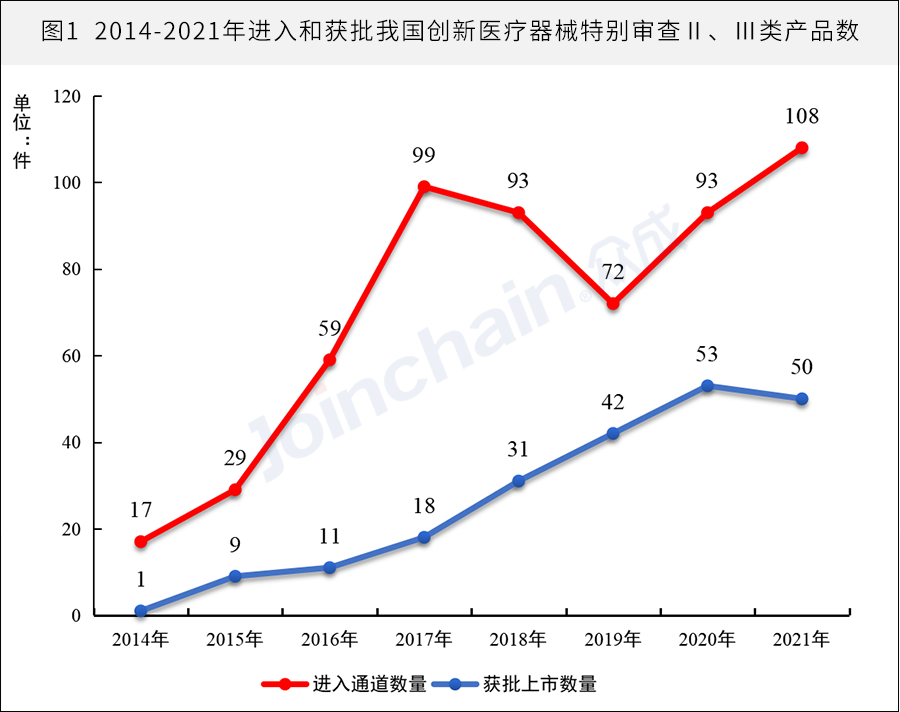
数据来源:JOINCHAIN® 众成数科
突破了注册审批环节的困难,创新医疗器械产品还要经历临床应用这个大关。从注册获批到进入临床应用,创新医疗器械产品需要经历医保核准、各级招标和医院品种遴选等多个环节。而这些流程都有窗口期,一旦错过就要等待下一个窗口。
不少获批产品在全球范围内实现了技术“无人区”的突破,却面临着用户不信任、国际同行挤压市场、临床接纳迟缓等窘境。相较于已经有成熟市场、渠道、用户认知的国际品牌,创新产品即使进入市场,可能也要长时间“坐冷板凳”。产品获批之后企业需要进行大量的临床技术培训推广工作,这当中所需的时间、费用、渠道资源对于科技型初创企业起来说,都是严峻考验。
临床应用是创新医疗器械商业变现的最终途径,如何直面国际龙头企业的竞争,改变多年临床使用习惯仍然是众多创新医疗器械面临的挑战。而此次北京市出台的《方案》,聚焦创新医疗器械临床应用薄弱环节,打造长效机制,能有效改善临床接纳迟缓问题,推动创新医疗器械全产业链发展。
近年来,北京市通过优化审评审批制度,针对创新医疗器械产品,开通绿色通道,实施专人负责、提前介入、全程指导等手段推动医疗器械创新发展。
2019-2021年,北京市共有27件创新产品获批,居全国第一。其中,2019获国家级创新审批的产品数量为3件,2020年4件,2021年增长至7件,创新产品数量、技术有明显提升。
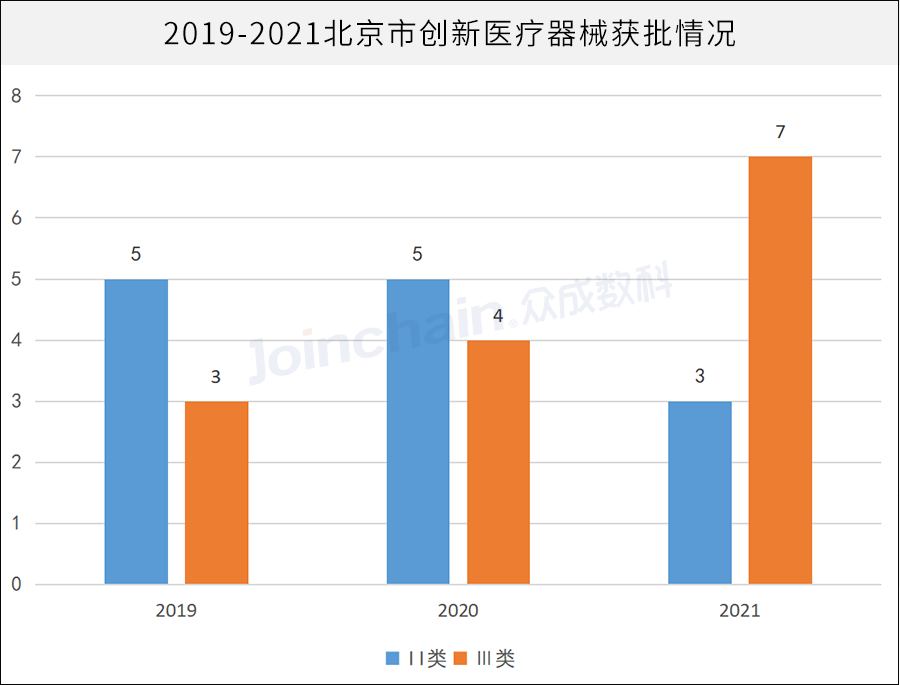
数据来源:JOINCHAIN® 众成数科
随着政策落地实施,相信将会有越来越多创新产品能真正实现其社会和经济效益,进一步参与全球产业竞争,提升国际话语权。