近日,广东省药监局发布《广东省药品监督管理局关于优化第二类医疗器械注册审评审批的若干措施》(以下简称《若干措施》)。
《若干措施》共有四部分20条,主要内容有:一是优化流程,实现全面提速。二是分级分路,提高办理效率。三是专门通道,大力支持创新。四是简化审批,服务产业发展。
01 提升效率注册审批时限缩短50%
《若干措施》明确省内第二类医疗器械注册技术审评时限比法定时限平均压缩50%。首次注册审评时限由法定60个工作日压缩至40个工作日,需要申请人补充资料的,补充资料后技术审评时限由法定60个工作日压缩至30个工作日。行政审批时限由法定20个工作日压缩至10个工作日。
同时对产品结构简单、生产工艺成熟、具备审评指导原则、临床应用风险小的产品设置单独审评通道,实行快速审评。据悉,目前已建立简易审评流程产品目录,包含口罩、防护服、义齿、质控品、校准品等。
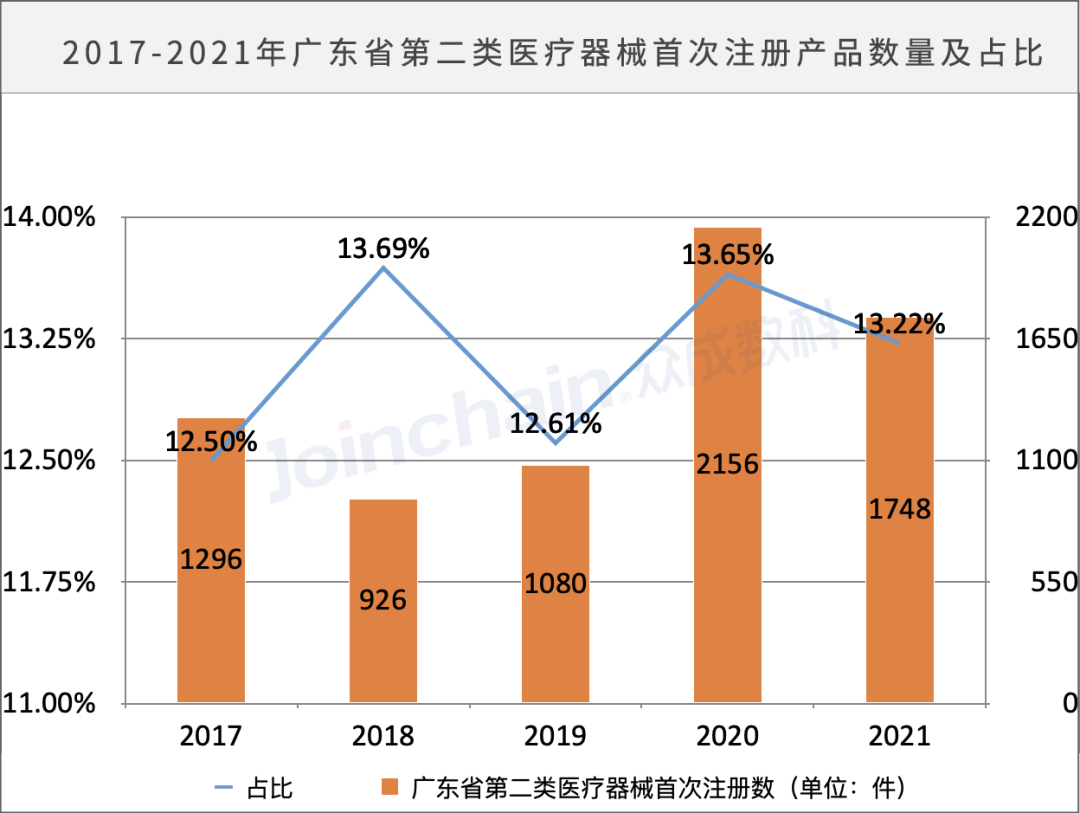
广东省作为医疗器械产业发达地区,产业集中度较高,初步形成了具有一定影响力和竞争力的医疗器械产业链。据众成数科统计,截止至2021年,广东省拥有5221家生产企业,位居全国第一;2017-2021年广东省第二类医疗器械首次注册产品数分别为1296、926、1080、2156、1748,占全国二类医疗器械首次注册总数的比例稳定在12%-14%之间。其中2021年首次注册数被湖南省赶超,跌至第二名。
《若干措施》的落地,将有助缩短广东省第二类医疗器械注册周期,加快推动优质产品获批上市。
02加强创新 全链条支持创新项目
《若干举措》还加强了对产品创新的支持力度,提出了全链条支持创新项目。对申报创新特别审批程序的项目,提前介入,实施“一对一”专人技术指导。对纳入创新特别审批通道的产品,在检验、审评、审批等各环节实行单独排队,随到随检、随到随审、随到随批。
此外,属于国家、省委、省政府医疗器械产业发展政策扶持方向的项目以及在省内首次申报的新项目,纳入优先审批程序,压缩时限,单独排队,优先检验检测、注册核查、审评审批,推动项目加快上市。
近年来为了推进医疗器械创新发展,广东省已出台多项措施,今年2月发布的《广东省推动医疗器械产业高质量发展实施方案》,将“提高医疗器械创新链整体效能”作为首要的重点任务,提出到2023年获批国家创新医疗器械注册证达到30个的发展目标。
据众成数科统计,截至5月24日,国家药监局共批准了160件创新产品注册。其中,广东省获批数为25件,位列全国第三,2017-2021年获批数分别为3件、4件、1件、5件、7件,虽然2019年有所回落,但整体形势仍然向好。
03创新环境优化 扶持政策纷纷出台
2022年以来,为了推动医疗器械创新发展,多个省市推出利好政策,2022年3月四川省发布《关于支持医疗健康装备产业高质量发展的若干政策措施》,对医疗健康装备重大科技专项、进口替代或国内首创的高端医疗健康装备和重点成套装备等产业化项目,按投资额10%的比例、给予最高不超过5000万元补助。
2022年4月福建省印发的《福建省加快生物医药产业高质量发展实施方案》明确对进入国家创新医疗器械特别审查程序获得产品注册证的三类医疗器械首次在福建省实现产业化的,每个品种给予200万元奖励,对其中的重大项目,经评审,每个品种给予最高600万元奖励。
2022年5月山东省发布的《关于促进医疗器械产业高质量发展的十六条措施》明确对纳入挂网交易范围的创新医疗器械及医用耗材,实行随报随挂、应上尽上。
广东省作为医疗器械产业大省,相关研制、生产、经营和使用都位居全国前列,《若干措施》的出台,不仅有助其进一步巩固发展地位,对于促进全国医疗器械产业发展同样有积极意义。