摘要
目的 分析上海市检验结果互认定量项目的检测性能,为医疗机构间检验结果互认工作的推进提供参考。方法 收集2020年上海市临床检验中心(SCCL)58个检验结果互认定量项目第2次室间质量评价(EQA)参评实验室回报结果,计算各项目EQA成绩和基于5种来源允许总误差(TEa)的西格玛(σ)度量。结果 有802家临床实验室回报结果,抗凝血酶原项目EQA合格率为92.59%,有18个项目EQA合格率为100.00%;分别有32.54%的公立医疗机构和67.46%的非公立医疗机构临床实验室成绩不合格。基于SCCL的TEa标准,有39个(67.24%)项目的σ度量>3;基于TEa的最大值,有51个(87.93%)项目的σ度量>3,有14个(24.14%)项目的σ度量>6;基于TEa的最小值,有12个(20.69%)项目的σ度量>3。结论 上海市各医疗机构临床实验室检验结果互认定量项目总体一致性较好,但部分检验项目不同医疗机构临床实验室检测结果存在差异,应引起重视。
关键词
室间质量评价;西格玛度量;检验结果互认;定量检测项目;上海市
医疗机构临床实验室间检验结果实现互认可提高医疗资源利用效率,切实减轻居民就医负担。2019年,上海市卫生健康委员会公布了35项临床检验结果互认项目;2021年,增加到102项,其中定量项目58项,定性项目44项。随着检验结果互认项目的逐渐增多,检测质量是否能满足临床要求,受到越来越多的关注。西格玛(sigma,σ)度量质量管理工具可较全面地评价检验项目性能。σ度量的评估数据可来源于室间质量评价(external quality assessment,EQA)结果,基于允许总误差(allowable total error,TEa)评价检验项目的检测性能。本研究基于国内外不同机构、组织公布的TEa要求,采用σ度量评估模式,对上海市不同医疗机构临床实验室58个检验结果互认定量项目的EQA结果进行分析,为上海市医疗机构间检验结果互认工作的进一步推进提供助力。
1 材料和方法
1.1 研究对象
收集2020年上海市临床检验中心(Shanghai Center for Clinical Laboratory,SCCL)组织的第2次EQA活动58个检验结果互认定量项目参评实验室回报结果,包括临床生化类33项、临床血液和体液类12项、临床免疫类13项。
1.2 质控品
除糖化血红蛋白项目质控品为SCCL自制外,其他57个项目质控品均为商品化质控品,质控品浓度覆盖临床参考区间的高、中、低值。依据2018年CNAS-GL003《能力验证样品均匀性和稳定性评价指南》要求对质控品进行均匀性和稳定性评价。评价合格后,向各临床实验室发放5个浓度水平的质控品。
1.3 方法
依据检测系统对临床实验室回报结果进行分组统计,基于SCCL的评价标准计算各项目的合格率,计算公式为:
合格率项目=合格实验室数/(合格实验室数+ 不合格实验室数)×100%
项目组变异系数(coefficient of variation,CV)的计算公式为:
CV组=(CV样本1+CV样本2+…+CV样本5)/5
组内各样本的CV为剔除离群值后各实验室检测结果的CV。
偏移(bias,Bias)的计算公式为:
Bias实验室=[(x样本1-x̅样本1)/x样本1+(x样本2-x̅样本2)/ x样本2+…+(x样本5-x̅样本5)/x样本5]/5
Bias组=(Bias实验室1+Bias实验室2+…+Bias实验室n)/n
式中x为实验室各样本的检测结果,x̅为组内各样本的靶值,n为各组实验室数,Bias实验室为各实验室的Bias,Bias组为项目组内各实验室剔除离群值后的Bias的均值。
σ度量的计算公式为:
σ组=(TEa-Bias组)/CV组
σ项目=(σ组1×n1+σ组2×n2+…+σ组i×ni)/N
式中i为项目的分组数,n为各组实验室数,N为项目总实验室数。
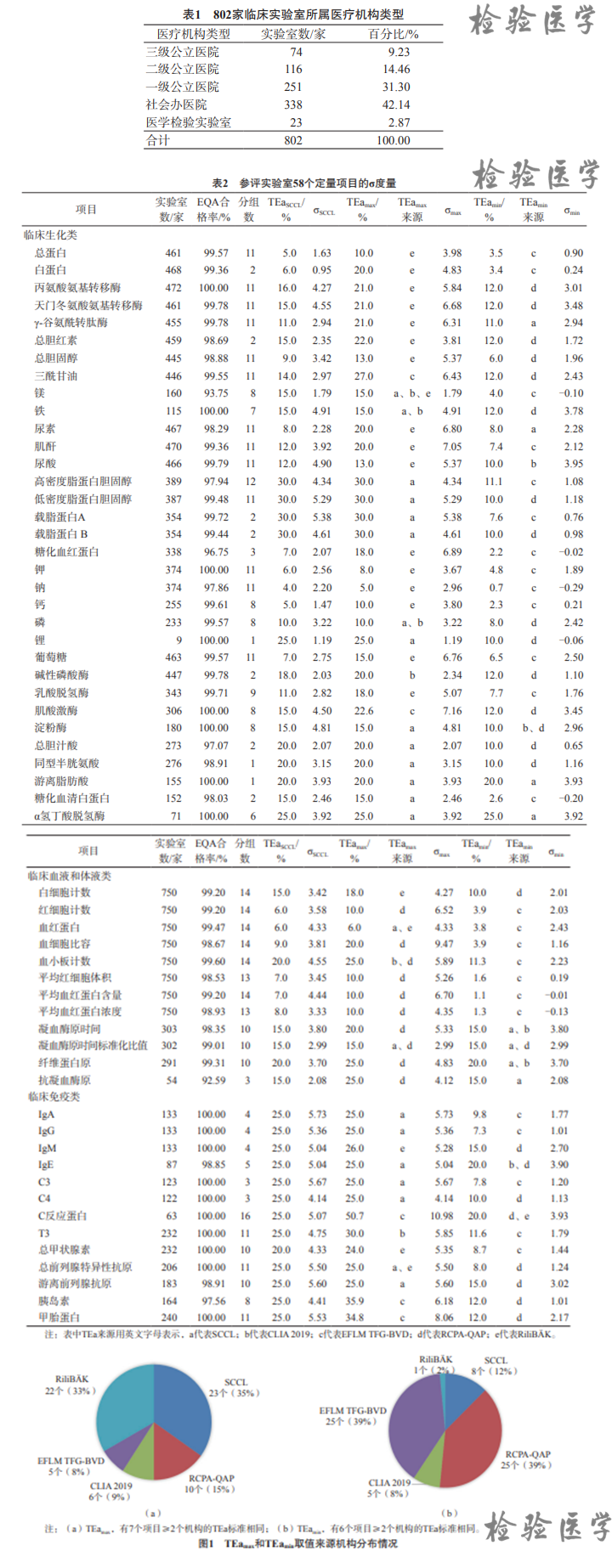
分别基于SCCL EQA计划、澳大利亚皇家病理学家学会质量保证计划(the Royal College of Pathologists of Australasia-Quality Assurance Programs,RCPA-QAP)、德国医学会检验医学质量保证指南(Guideline of the German Medical Association on Quality Assurancein Medical Laboratory Examinations,RiliBÄK)、美国临床实验室修正法案2019(the Clinical Laboratory Improvement Amendments 2019,CLIA 2019)和欧洲临床化学与检验医学生物学变异数据库工作组(European Federation of Clinical Chemistry and Laboratory Medicine Task and Finish Group for the BV Database,EFLM TFG-BVD)公布的适当标准这5种来源的TEa标准计算最大和最小σ度量。SCCL数据来源于https://www.sccl.org.cn/,RCPA-QAP数据来源于https://rcpaqap.com.au/,RiliBÄK和CLIA 2019数据来源于http://www.westgard.com,EFLM TFG-BVD数据来源于https://biologicalvariation.eu/。
2 结果
2.1 参评实验室所属机构类型
有802家临床实验室参加2020年SCCL组织的58个检验结果互认定量项目第2次EQA。参评实验室所属机构类型见表1。
2.2 参评实验室EQA成绩
802家临床实验室58个定量项目的EQA合格率为92.59%~100.00%;有18个(31.03%)项目的合格率为100.00%,见表2。有40个(68.97%)项目出现合计169个不合格结果,其中社会办医院103个(60.95%)、一级公立医院28个(16.57%)、二级公立医院20个(11.83%)、医学检验实验室11个(6.51%)、三级公立医院7个(4.14%)。
2.3 58个定量项目的σ度量
58个定量项目的σ度量因基于不同来源的TEa而结果不同。基于SCCL的TEa,有39个(67.24%)项目的σ度量>3。基于最大的TEa(TEamax),有51个(87.93%)项目的σ度量>3,有14个(24.14%)项目的σ度量>6。基于最小的TEamax,有12个(20.69%)项目的σ度量>3。TEamax主要来源于SCCL和RiliBÄK,TEamin主要来源于RCPA-QAP和EFLM TFG-BVD。见表2、图1。
3 讨论 采用σ度量评估检验项目的分析性能可为不同性能特征的检验项目建立质量基线,使其具有可比性。σ度量评估的是临床实验室的检测失误,或不符合的结果:如6σ表示每百万个检测结果中发现3.4个不符合结果,3σ表示每百万个结果中发现66 807个不符合结果,3σ常被作为最低的标准。上海市检验结果互认工作的前提是患者从不同医疗机构临床实验室获得一致的检测结果,这就要求各临床实验室的检验结果具有可比性,即各临床实验室的不符合检验结果在可接受范围内。因此,本研究将上海市所有医疗机构临床实验室定义为1家“临床实验室”,以探讨定量项目当前的检验质量水平。 本研究分析了上海地区802家临床实验室58个检验结果互认定量项目SCCL 2020年第2次EQA结果,涉及的临床实验室覆盖上海市各级别、各类型医疗机构。SCCL于2012年通过中国合格评定国家认可委员会(China National Accreditation Service for Conformity Assessment,CNAS)能力验证提供者质量管理体系(ISO 17043)认可,58个检验结果互认定量项目都在认可范围内。在保证EQA样本是均匀且稳定的前提下,SCCL依据认可的统计流程对临床实验室的检测结果进行评价,以确保所有临床实验室的质量水平得到正确的判断。 EQA是保证检验质量缺一不可的关键环节,也是检验结果互认的重要依据。本研究结果显示,802家临床实验室58个定量项目尚未完全达到100.00%的EQA合格率,仅31.03%的项目EQA合格率为100.00%。有不合格成绩的临床实验室中,67.46%为社会办医医院的临床实验室。提示应加强非公办医疗机构临床实验室的检验质量监管,以帮助检验结果互认工作在全市范围内的推进。 σ度量是结合了CV、Bias和TEa这3个关键的检测性能参数的结果计算而来的,可客观、公正地评估检验项目的性能。对于单个实验室,通常按照CLSI EP5-A2推荐的20 d方案确定定量项目检测方法的不精密度(CV)水平。Bias的来源通常是基于检测结果与EQA靶值的比较,或与参考方法/参考物质比较所得,前者是常见的方式。本研究分析了上海地区802家临床实验室58个定量项目的整体质量水平,考虑到不同检测系统之间检测结果存在差异,因此本研究按检测系统分组来评估临床实验室检测结果的CV和Bias,以得到不同检测系统的σ度量,再加权计算各项目的σ度量。 确定适当的TEa是当前σ度量计算中最具有争议的焦点,对于同一检验项目,不同国际组织、国家和室间质评组织的标准是不同的,选择不同的TEa将会得到不同的σ度量。JONES等认为,TEa标准不同的原因可能为其评价背后的意义不同。有的EQA计划是“教育性的”,不存在任何处罚,因此其制定的TEa标准趋向于较高的要求;有的EQA计划具有政策性的后果,对于临床实验室而言可能导致严重的财政等处罚,因此其制定的TEa标准会相对宽泛。前者如中国,TEa的制定原则通常是让80%的临床实验室能满足要求;后者如德国,临床实验室EQA成绩不合格会产生严重的后果,因此其制定的TEa标准是让几乎所有实验室均能满足要求。 不同的σ度量会影响到实验室的实际质量控制计划。TEa选择的值越大,σ度量越好,但不易发现潜在的质量问题,不利于检验质量水平的提高。反之,σ度量越小,越容易造成不必要的医疗资源浪费。EFLM TFG-BVD确定了TEa来源的3种模式:(1)模式1是基于对临床结果的影响,针对对临床决策起关键作用的项目,如糖化血红蛋白;(2)模式2来源于生物学变异,针对不对临床决策起判断作用,但是性能较稳定的项目,如钾、钠、氯;(3)模式3是基于当前技术水平,包括除模式一、二针对项目外的其他项目。本研究选取了包括SCCL在内的国内外五大机构的TEa标准,内容涵盖了上述3种模式,结果显示,58个定量项目的TEa,EFLM TFG-BVD和RCPA-QAP的标准相对严格,各占38%的TEamin项目。RiliBÄK和SCCL制定的TEa标准较其他机构宽松,分别占32%和35%的TEamax项目。原因可能为EFLM TFG-BVD使用的是TEa基于生物学变异数据库。RCPA-QAP的TEa标准也接近生物学变异,而RiliBÄK和SCCL主要依据当前技术水平制定TEa。 本研究依据不同来源的TEa得到了不同的σ度量。选取SCCL使用的TEa, 有39个(67.24%)项目的σ度量>3;采取最宽泛的TEa值,σ>3的项目数量为51个(87.93%)。提示使用SCCL制定的TEa标准,当前上海地区各临床实验室检验结果互认定量项目的质量水平还具有极大的提升空间。原因可能在于本研究得到的CV是来自多家临床实验室的检测结果,对于检测结果一致性的影响因素(人员、设备、环境)较单家临床实验室多且复杂。对于这一问题,可通过加强相关临床实验室对EQA结果的质量分析,以及相关互认项目的质量督查等方式来解决,以提高不同医疗机构临床实验室检测结果的一致性。选择最严格的TEa值,本研究σ>3的项目数量为12个(20.69%)。提示在当前技术水平下,上海地区部分检验项目的检测性能在国际上具有较好的水平。SCCL的TEa标准主要来源于《WS/T 403—2012 临床生物化学检验常规项目分析质量指标》《WS/T 406—2012临床血液学检验常规项目分析质量要求》和当前技术水平。由于TEa的标准会随着当前技术水平的提高而发生变动,从而影响到σ度量,因此临床实验室和相关质量监管机构在评估互认项目的检测性能时,需考虑到TEa的选择标准。 理想情况下,Bias应是通过比较临床实验室检测结果与正确度验证计划中的参考值而获得的,而本研究是通过比较临床实验室检测结果与EQA的靶值获得的,从而得到的σ度量可更好地反映实验室间结果的一致性。 综上所述,上海市各医疗机构临床实验室检验结果互认定量项目总体上具有较好的一致性,可实现上海市医疗机构临床实验室间此类项目检验结果的互认,但是部分检验项目不同医疗机构临床实验室之间检测性能存在差异,应引起重视,加强检验质量管理,以进一步推进医疗机构间的检验结果互认。 参考文献(略)